来源:生物世界


撰文丨王聪 编辑丨王多鱼 排版丨水成文骨髓(BM)中恶性细胞不受控制的克隆性增殖导致了大多数血液系统恶性肿瘤,其死亡率和复发率都很高急性髓系白血病(AML;源自恶性造血干细胞)和多发性骨髓瘤(MM;源自恶性浆细胞)。
这两种主要的血液系统恶性肿瘤,在老年人中的发病率较高,近年来发病率显著上升 尽管化疗、免疫治疗和细胞治疗等各种疗法在延长血液系统恶性肿瘤患者的总体生存期方面显示出了希望,但在充分清除骨髓内的肿瘤细胞、显著减轻伴随的肿瘤外毒性作用以及有效预防疾病复发方面仍然存在挑战。
此外,目前还没有有效靶向骨髓中肿瘤细胞的得治疗方法 因此,当务之急是设计一种能够克服这些限制的治疗方法,满足血液系统恶性肿瘤治疗中未满足的需求2024年7月23日,中国药科大学李斯文教授、顾月清教授团队合作,在 Nature 子刊
Nature Nanotechnology 上发表了题为:A bispecific nanosystem activates endogenous natural killer cells in the bone marrow for haematologic malignancies therapy
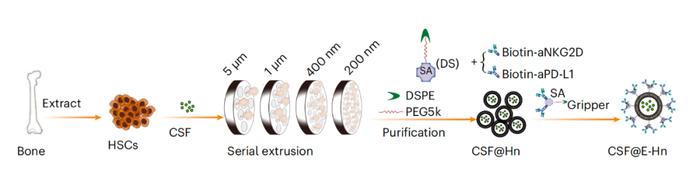
的研究论文该研究开发一种骨髓靶向纳米系统——CSF@E-Hn,用于治疗血液系统恶性肿瘤,该系统在造血干细胞来源的纳米囊泡(Hn)表面修饰了NK细胞激活配体(aNKG2D)和肿瘤相关抗体(aPD-L1),并封装了集落刺激因子
(CSF),能够靶向骨髓,将肿瘤细胞和NK细胞聚集在一起,进而激活NK细胞以特异性靶向和消除骨髓中的肿瘤细胞该系统在急性髓系白血病(AML)和多发性骨髓瘤(MM)小鼠模型中显示了良好的治疗效果,且能够长期防止肿瘤复发。

由于缺乏可靠的体内骨髓靶向技术,特异性根除骨髓中肿瘤细胞的治疗策略鲜有报道源自骨髓的造血干细胞(HSC)通过与血管内皮细胞黏附因子以及诸如CD44和CXCR-4等表面自导向受体相互作用,已被用作骨髓归巢的载体。
然而,造血干细胞的体外扩增、致瘤性和较大的体积阻碍了它们更广泛的应用相比之下,造血干细胞来源的纳米囊泡(简称Hn)具有与母细胞相同的细胞特征,由于其载药双层结构、较小的尺寸和较低的免疫原性,被认为是一种理想的骨髓靶向载体。
自然杀伤(NK)细胞在骨髓(BM)中成熟并聚集,已被研究作为潜在的抗癌制剂,具有直接攻击癌细胞的能力然而,NK细胞上抑制性和激活性受体传递的信号的负面失衡限制了它们消除肿瘤细胞的有效性此外,与实体瘤相比,血液肿瘤细胞的扩散性质使NK细胞难以有效地捕获和消除它们。
因此,迫切需要制定一种策略,在实现NK细胞激活的同时追踪肿瘤细胞在这项最新研究中,研究团队在造血干细胞来源的纳米囊泡(Hn)表面设计了aPD-L1抗体(肿瘤相关抗体)和aNKG2D(NK细胞激活配体),以使NK细胞和肿瘤细胞更紧密地结合,同时激活NK细胞,在骨髓内进行有针对性和有效的治疗
在血液系统恶性肿瘤的病理状态中,造血抑制和骨形成受损始终存在,这有利于肿瘤细胞的存活和扩增,最终导致疾病复发作为一种有效的造血生长因子和免疫调节剂,集落刺激因子(CSF)可以通过促进造血干细胞分化、增加记忆T细胞的产生以及维持骨稳态来重塑骨髓微环境,这将在消除初始肿瘤后防治肿瘤再次复发。
因此,将集落刺激因子(CSF)与基于造血干细胞来源的纳米囊泡(Hn)的靶向治疗策略相结合,可以改善骨髓微环境以增强治疗效果,并提供持续的长期抗侵袭能力研究团队构建了功能性双特异性纳米系统——CSF@E-Hn。
,该系统将NK细胞激活配体(aNKG2D)和肿瘤相关抗体(aPD-L1)修饰在造血干细胞来源的纳米囊泡的表面(E-Hn),通过激活骨髓中的内源性NK细胞,展现出优异的骨髓靶向性以及强大的肿瘤细胞捕获和杀伤能力
。此外,集落刺激因子(CSF)被封装在Hn内,以调节骨髓微环境并抑制肿瘤的扩散和复发。
具体来说,该研究开发的骨髓靶向纳米系统CSF@E-Hn,能够靶向骨髓,将肿瘤细胞和NK细胞聚集在一起,进而激活NK细胞以特异性靶向和消除骨髓中的肿瘤细胞实验结果显示,CSF@E-Hn能够有效治疗患有急性髓系白血病
(AML)和多发性骨髓瘤(MM)的小鼠模型。
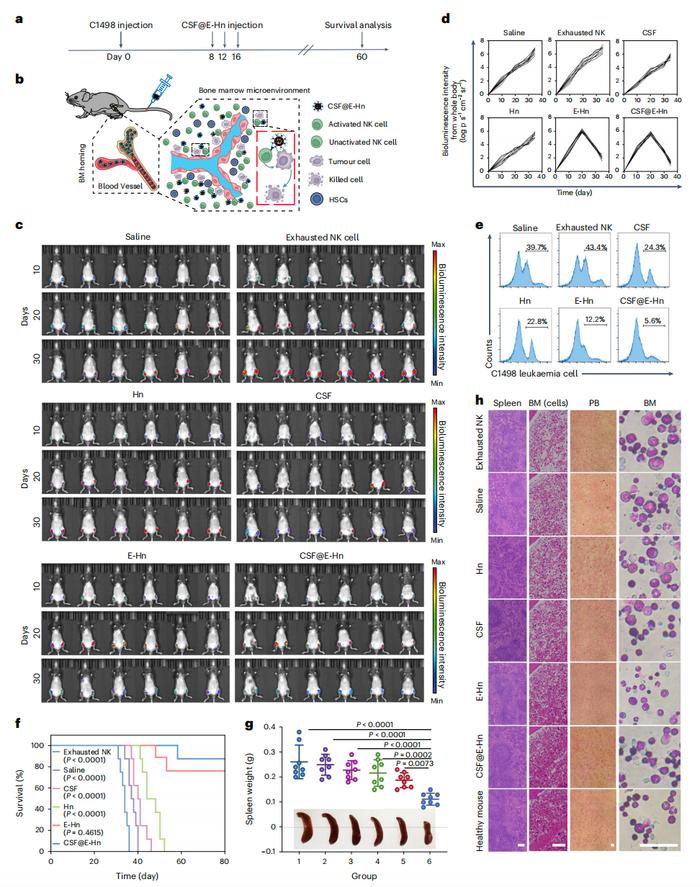
CSF@E-Hn治疗急性髓系白血病
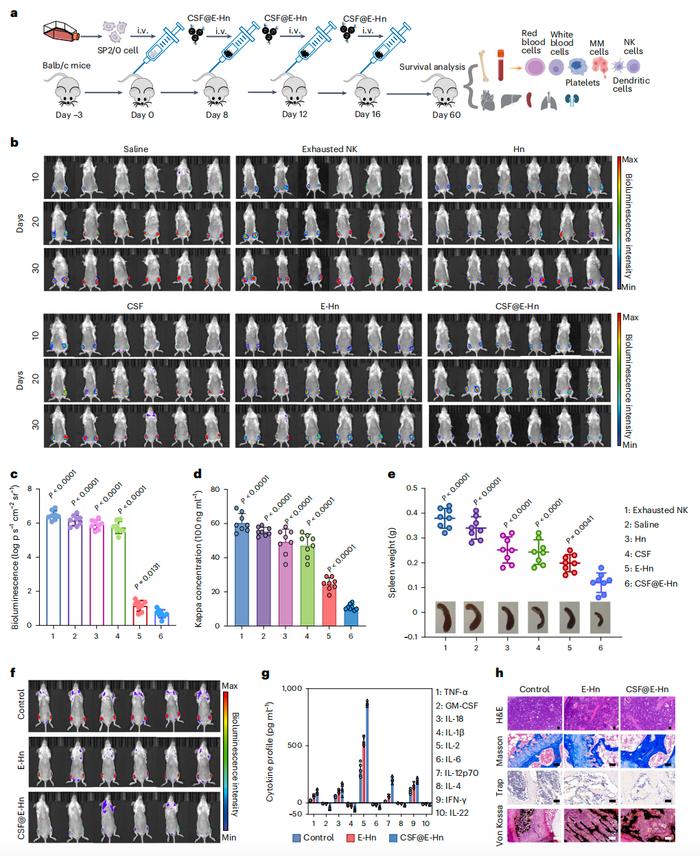
CSF@E-Hn治疗多发性骨髓瘤对治疗后骨髓微环境的综合评估表明,将CSF整合到骨髓靶向纳米系统中,促进了造血干细胞的分化,促进了记忆T细胞的生成,并维持了骨稳态,能够长期防止复发该纳米系统为治疗血液系统恶性肿瘤提供了一种很有前景的新策略。
论文链接: https://www.nature.com/articles/s41565-024-01736-9
亲爱的读者们,感谢您花时间阅读本文。如果您对本文有任何疑问或建议,请随时联系我。我非常乐意与您交流。


发表评论:
◎欢迎参与讨论,请在这里发表您的看法、交流您的观点。